|
|
Angiogénesis en la hiperplasia de células de Leydig inducida con cloruro de cadmio: estudio inmunohistoquímico y cuantitativo
Dra. Adelaida Iglesias Docampo1
,
Dr. Vicente Gómez del Olmo1
,
Dra. Rocío Martín López1,2
y
Prof. Luis Santamaría Solís1
1. Departamento de Morfología. Facultad de Medicina. UAM, Madrid. España
2. Sección de Patología (Anatomía Patológica). Hospital N.Sra de Sonsoles, Ávila. España.
España
|
|
|
|
|
|
|
|
Resumen
|
|
|
|
INTRODUCIÓN. Tras la administración de cadmio por vía oral a ratas aparecen hiperplasias de células de Leydig. En algunos estudios se ha esbozado una relación entre estas hiperplasias y un aumento de los vasos sanguíneos en el intersticio; en otros se relaciona la proliferación endotelial con factores segregados por las propias células de Leydig. En este trabajo se pretende evaluar la proliferación, apoptosis y número de células endoteliales, así como la longitud de los microvasos, comparando controles con animales tratados con cadmio.
MATERIAL Y MÉTODOS. Se utilizaron 44 ratas macho pospuberales Sprague-Dawley. Veinticinco se trataron con cloruro de cadmio a una concentración de 80 ppm., administrado contínuamente en el agua de la bebida. Las diecinueve restantes fueron utilizadas como controles, sin cadmio. Se sacrificaron a los 18 meses y se estudiaron los dos testículos de cada rata. Se hizo inmunohistoquímica para PCNA (proliferación celular) y colágeno IV (membranas basales vasculares) y detección de apoptosis mediante técnica TUNEL.
El estudio cuantitativo se realizó determinando los índices de proliferación celular (LIPCNA) y de apoptosis (LIAPOPT), la densidad numérica de las células endoteliales (NVEND) y la longitud de los vasos intersticiales (LVVAS) mediante métodos estereológicos no sesgados.
RESULTADOS. Se detectó un aumento estadísticamente significativo (p<0.05) en la proliferación, apoptosis y densidad numérica de las células endoteliales y en la longitud de los vasos intersticiales, de las hiperplasias con respecto a controles y tratados sin hiperplasia.
CONCLUSIONES. En la hiperplasia de células de Leydig inducida por el cloruro de cadmio aparece un aumento de la vascularización del intersticio, tanto del número absoluto de células endoteliales, como en la longitud de los microvasos. Esta neoangiogénesis se produce por una mayor proliferación de las células endoteliales, aunque también hay un aumento de la apoptosis.
|
|
|
|
|
|
|
Introducción
|
|
|
|
El cadmio es un metal pesado de amplio uso en la industria, sólo en EEUU más de 5 millones de kilogramos al año (galvanoplastia, baterías, grabados, etc.) En agricultura se utilizaban pesticidas fosfatados que contenían cadmio, hoy prohibidos, que han aportado concentraciones variables de este metal a alimentos como el trigo y el arroz (1) También se encuentra de forma natural en la mayoría de minerales y suelos, en relación con el zinc.
El 50% del cadmio absorbido se concentra en el hígado y en los riñones. En eritrocitos y tejidos blandos, el cadmio se une a la metalotioneina, polipéptido de bajo peso molecular (6800 Da) que contiene un gran número de grupos sulfidrilos disponibles que ejercen un efecto protector. En las exposiciones a una gran dosis única de cadmio se puede producir la saturación de la proteína y la pérdida del efecto protector. El cadmio no atraviesa la placenta y se acumula gradualmente en el organismo con la edad, aumentando su concentración en los órganos reproductivos, sobre todo epidídimo y vesículas seminales. En el testículo no se hace evidente el acúmulo de cadmio hasta la cuarta década de la vida, cuando el efecto potencialmente perjudicial sobre la fertilidad masculina tiene menor relevancia (2)
Su vida media biológica se ha calculado en más de 20 años, excepto si existen daños renales en los que se produce una mayor excreción urinaria.
El testículo es uno de los órganos más sensibles a la acción lesiva del cadmio. En ellos se producen lesiones severas tras la administración de dosis muy inferiores de las que se requieren para producir lesión en otros órganos (3). En la próstata de la rata produce alteraciones ultraestructurales: alteración de las organelas y una redistribución del zinc intracelular.
En cuanto a la carcinogénesis del cadmio, los estudios en animales de laboratorio utilizan vías de exposición muy diferentes a las naturales, como la subcutánea y la intramuscular, que producen tumores en el lugar de la inyección, especialmente sarcomas (4). La exposición en el hombre es de forma crónica, vía oral o inhalatoria. A pesar de la ambigüedad de los resultados de los estudios epidemiológicos los datos actuales parecen apoyar un papel del cadmio como sustancia carcinogenética en humanos, y se han descrito casos de tumores pulmonares y prostáticos. En el testículo los tumores más frecuentes son los de células intersticiales. Se han descrito también seminomas, adenocarcinomas de la rete testis y tumores mixtos de células de Leydig y células de Sertoli (5). Otros tumores observados son los del sistema hematopoyético, pancreáticos, renales y hepáticos, en animales de experimentación.
Las hiperplasias y adenomas de células de Leydig se observan con frecuencia en los estudios de toxicidad crónica de agentes químicos en animales de laboratorio, incluido el cloruro de cadmio. No está claro la influencia de la exposición crónica del ser humano a estos agentes (6). En algunos estudios se ha esbozado una relación entre estas hiperplasias y un aumento de los vasos sanguíneos en el intersticio (7).
|
|
|
|
|
|
|
Material y Métodos
|
|
|
|
Animales
Para este estudio se han utilizado 44 ratas Sprague-Dawley macho, postpuberales. El peso medio por animal al comienzo del experimento fue de 300 gramos. Veinticinco de las ratas se trataron con cloruro de cadmio (Panreac, Barcelona) a una concentración de 80 ppm, administrado contínuamente en el agua de la bebida; las diecinueve restantes fueron utilizadas como controles, recibiendo agua de bebida carente de cadmio. De cada animal se estudiaron los dos testículos resultando por lo tanto, 50 testículos experimentales y 38 testículos controles. Todos los animales se mantuvieron en tratamiento durante 18 meses.
Procesado de los tejidos
Finalizado el experimento, los animales se sacrificaron por exanguinación tras narcosis profunda con dióxido de carbono, inmediatamente se disecaron y extrajeron ambos testículos. Se realizaron punciones en la cápsula testicular con aguja para crear pequeños agujeros que faciliten la entrada del líquido fijador, evitando la deformación del órgano. Se fijaron por inmersión en methacarn (metanol, cloroformo y ácido acético en proporciones 6:3:1) durante 24 horas. Se realizaron rodajas transversales perpendiculares al eje mayor testicular, de 3 mm de diámetro. Después se deshidrataron en serie creciente de alcoholes, se incluyeron en parafina y se efectuaron secciones de 5 micras de grosor para la realización de las técnicas morfométricas e inmunohistoquímicas y de 20 micras para las técnicas estereológicas. Los cortes fueron fijados posteriormente al portaobjetos con Poly-L-Lisina. Luego se procedió a la selección aleatoria de bloques y cortes para su posterior valoración por tecnicas estereológicas.
Estudio inmunohistoquímico
Las secciones de los tejidos, rehidratadas en serie decreciente de alcoholes, fueron incubadas con peróxido de hidrógeno (0.3 % en Buffer fosfato salino –PBS- pH 7.4) durante 30 minutos para inactivar la peroxidasa endógena.
Se utilizó un anticuerpo primario para detectar colágeno IV, policlonal, a una dilución 1/100 (Biogenex. San Francisco CA. USA) para realizar la inmunohistoquímica, previa digestión enzimática con pepsina diluida al 0.1% en solución de HCL 0,1 M a 37º C durante 2 minutos. Se incubó durante 24 horas a 4ºC. El anticuerpo secundario fue una inmunoglobulina biotinilada anticonejo, obtenida en cabra (Dako, Glostrup, Denmark), diluida 1/400. El tiempo de incubación fue de 30 minutos a temperatura ambiente.
También se hizo inmunohistoquímica para PCNA (antígeno nuclear de proliferación celular) a dilución 1/400, monoclonal (Biomeda Foster City; CA, USA). El anticuerpo secundario fue una inmunoglobulina biotinilada de ratón, obtenida en conejo.
Posteriormente se trataron las preparaciones con el complejo avidina-biotina-peroxidasa (Dako). A continuación se realizó el revelado con diaminobencidina (Sigma, Barcelona, España) y después el contraste nuclear con verde de metilo o con hematoxilina de Harris. La deshidratación se hizo en alcoholes crecientes y xilol y el montaje con Depex.
La especificidad de las reacciones inmunohistoquímicas se comprobó por incubación de las secciones con suero no inmune como sustituto del anticuerpo primario.
Estudio de la apoptosis
Para la visualización de los núcleos apoptóticos se empleó la técnica TUNEL (Terminal deoxytransferase TdT-mediated dUTP-Biotin Nick end labeling) usando el kit para la detección de la muerte celular in situ (Roche Diag. Barcelona, España)
Cuantificación estereológica
Todas las medidas fueron realizadas utilizando un microscopio Olimpus provisto de un objetivo de inmersión X100 (apertura numérica de 1,4) a unos aumentos finales de X1200. El microscopio está conectado a una videocámara y provisto con una platina motorizada conectada a su vez con un ordenador Commodore Amiga 2000. El programa utilizado (Stereologic Software Package GRID, Interactivision, Silkeborg, Denmark) regula el desplazamiento en XY de la platina y permite el muestreo automático de los campos microscópicos a medir. Estos campos fueron seleccionados mediante muestreo sistemático al azar después de la introducción vía teclado de una apropiada fracción de muestreo. El programa genera el retículo del disector que se superpone a la imagen microscópica capturada por la cámara y proyectada por el monitor.
Evaluación de la proliferación de células endoteliales.
Se cuantificó mediante el índice de marcaje para PCNA (LIPCNA), tanto en los casos controles como en los tratados con cadmio; se evaluaron separadamente las zonas hiperplásicas y las zonas ocupadas por células de Leydig aparentemente normales. El LIPCNA se calcula:
Nº de núcleos inmunorreactivos para PCNA X 100 / Nº de núcleos inmunorreactivos para PCNA + Nº de núcleos PCNA negativos.
Los contajes se realizaron mediante el programa GRID. Se consideraban positivos todos los núcleos que expresaban PCNA independientemente de la intensidad de la reacción. Se valoró un promedio de 100 campos / corte.
Evaluación de la apoptosis de células endoteliales.
Se cuantificó mediante el índice de marcaje para apoptosis (LIAPOPT). Se ha evaluado en casos controles y en tratados, tanto en las zonas de hiperplasia de células de Leydig como en las zonas libre de ellas. Se calculó de la siguiente manera:
Nº de núcleos apoptóticos X 100 / Nº de núcleos apoptóticos + Nº de núcleos no apoptóticos
Los contajes se realizaron mediante el programa GRID. Se consideraban positivos todos los nucleos que expresaban una tinción intensa y uniforme. Se valoró un promedio de 150 campos / corte.
Evaluación de la densidad numérica (NV) de células endoteliales
Para la estimación de NV, en controles, intersticio no hiperplásico de animasles tratados (experimentales) e hiperplasias de animales tratados, se ha utilizado el principio del disector óptico (8,9), un método estereológico no sesgado (10). Los datos se expresaron como número de células endoteliales / mm3 de tejido.
Se seleccionó en cada testículo, mediante muestreo sistemático al azar, una rodaja del material incluido en parafina. De los cortes seleccionados se efectuaron cortes de 20 micras de grosor que se tiñeron con hematoxilina-eosina. Se seleccionaron para la medición 3 cortes por bloque, también mediante muestreo sistemático al azar.
Se utilizó el mismo equipo de microscopio y de informática que en los casos anteriores.
Evaluación de la longitud de los microvasos
Para evaluar la longitud de los microvasos se calcula la densidad de longitud es decir, longitud de microvaso / mm3 de tejido (LV), tanto en controles como en tratados con cadmio, en las zonas donde las células de Leydig son normales y en donde forman hiperplasias y adenomas. LV se calcula con la siguiente fórmula:
LV = 2 . Sum Q / Nº de campos . Área del disector
Q: número de perfiles vasculares inmunoteñidos que reunen los criterios de inclusión.
Área del disector: 1490 micras2
Para evidenciar la presencia de microvasos se realiza inmunotinción para colágeno IV, que tiñe las membranas basales de los endotelios.
Estadística
Se realiza comparación entre las medias de los parámetros estimados en los casos control y en los casos tratados mediante la t de Student. Se establece significación estadística para p<0.05.
|
|
|
|
|
|
|
Resultados
|
|
|
|
Hallazgos cualitativos
En las ratas experimentales de 18 meses de evolución se detectan hiperplasias de células de Leydig (Fig.1). Se observa inmunoexpresión de colágeno IV en la pared de los vasos tanto del intersticio normal, como de las hiperplasias (Fig.2). Las células de Leydig en las hiperplasias también están rodeadas por una trama de colágeno IV.
Se observa un incremento de núcleos de células endoteliales inmunoreactivos para PCNA en los microvasos de las hiperplasias, en comparación con el intersticio no hiperplásico de los animales tratados y de los controles (Fig.3). Así mismo se detecta un aparente incremento de núcleos positivos con la técnica TUNEL para apoptosis, en el endotelio de las hiperplasias (Fig.4).
Cuantificación de la proliferación de células endoteliales
El índice de proliferación de las células endoteliales es significativamente mayor en las hiperplasias de células de Leydyg con respecto a los casos controles y a los experimentales. Entre estos últimos no aparecen diferencias significativas (Fig.5 a).
Cuantificación de la apoptosis de las células endoteliales
El índice de apoptosis de las células endoteliales es significativamente mayor en los casos de hiperplasia de células de Leydig que en los casos controles y que en los experimentales. Entre estos dos últimos no aparecen diferencias significativas (Fig.5 b).
Densidad numérica de las células endoteliales
Es significativamente mayor en los casos con hiperplasia de células de Leydig que en los casos controles y que en los experimentales. Entre estos dos últimos no aparecen diferencias significativas (Fig.5 c).
Longitud de los microvasos
Los microvasos de los casos de hiperplasia son significativamente más largos que los que aparecen en los casos controles y en los experimentales. Además, no hay diferencia significaticva entre los casos controles y los experimentales (Fig.5 d).
|
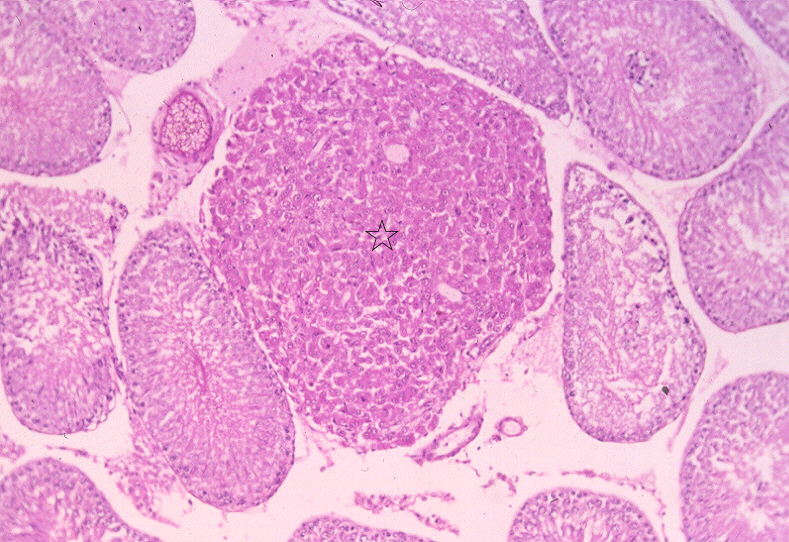 Zoom Zoom
|
|
|
Testículo de rata tratada con cadmio durante 18 meses. Se observa un adenoma de células de Leydig en el centro del campo, que comprime los túbulos seminíferos circundantes. HE, 150X.
|
 Zoom Zoom
|
|
|
a-Adenoma de células de Leydig (estrella) inmunoteñido para colágeno tipo IV, se detectan abundantes microvasos inmunorreactivos en el interior del adenoma. Se observan vasos inmunoteñidos en el intersticio no adenomatoso (cabeza de flecha). Inmunotinción para Colágeno-IV, 150X.
b-Mayor detalle de la imagen anterior. Inmunotinción para Colágeno-IV, 500X.
|
 Zoom Zoom
|
|
|
a-Testículo de rata control inmunoteñido para PCNA. Se observan ocasionales núcleos de células de Leydig inmunorreactivos (cabeza de flecha), no se detecta inmunorreactividad en el endotelio del intersticio testicular. Inmunotinción para PCNA, 300X.
b-Testículo de rata sometida a la acción del cadmio durante 18 meses. Se detecta una pequeña hiperplasia que muestra microvasos con núcleos del endotelio inmunorreactivos para PCNA (cabezas de flecha). Inmunotinción para PCNA, 300X.
|
 Zoom Zoom
|
|
|
a-Testículo de rata sometida a la acción del cadmio durante 18 meses teñido con la técnica TUNEL. Se observa un núcleo de célula de Leydig apoptótico (cabeza de flecha) en una zona no hiperplásica del intersticio, no se observan células endoteliales apoptóticas. TUNEL, 400X.
b-Hiperplasia en un testículo de rata sometida a la acción del cadmio durante 18 meses teñido con la técnica TUNEL. Se observan dos núcleos endoteliales apoptóticos (cabezas de flecha). TUNEL 400X.
|
 Zoom Zoom
|
|
|
a-Diagrama de barras que muestra el LIpcna de las células endoteliales, expresado como media ± SD en controles, intersticio experimental no hiperplásico e hiperplasias. El asterisco indica diferencias significativas con el resto de los grupos para p<0.05.
b-Diagrama de barras que muestra el LIapop de las células endoteliales, expresado como media ± SD en controles, intersticio experimental no hiperplásico e hiperplasias. El asterisco indica diferencias significativas con el resto de los grupos para p<0.05.
c-Diagrama de barras que muestra el NV de las células endoteliales, expresado como media ± SD, en controles, intersticio experimental no hiperplásico e hiperplasias. El asterisco indica diferencias significativas con el resto de los grupos para p<0.05.
d-Diagrama de barras que muestra el LV de microvasos, expresado como media ± SD, en controles, intersticio experimental no hiperplásico e hiperplasias. El asterisco indica diferencias significativas con el resto de los grupos para p<0.05.
|
|
|
|
|
|
|
|
Discusión
|
|
|
|
En la hiperplasia de células de Leydig inducida por el cloruro de cadmio, también descrita por otros autores (4,5,11) aparece un aumento de la vascularización del intersticio, que es debida a un aumento del número absoluto de células endoteliales consecuencia de un incremento de la proliferación de esta población celular. También se observa una elevación de la tasa de apoptosis en la población de células endoteliales, que obviamente debe ser de menor cuantía que la proliferación puesto que el número absoluto de células endoteliales aumenta. Un hecho a resaltar es que los neovasos formados son de mayor longitud que los vasos de los animales sin tratar.
Lo curioso es que el cadmio induce angiogénesis sólo en aquellos casos en que aparece hiperplasia de las células de Leydig y no en los casos tratados pero en los que no se forman las hiperplasias. Además, en todos los focos de hiperplasia de células de Leydig hay un aumento de la angiogénesis. Parece como si la proliferación de las células de Leydig y la proliferación de las células endoteliales tuvieran un control simultáneo, si no por genes idénticos, sí por mecanismos que se disparan a la vez o por lo menos muy cerca uno de otro en el tiempo. La teoría más aceptada es que primero se forma un tumor de pequeño tamaño y las propias células tumorales en las fases más precoces son las responsables de la liberación de los factores proangiogénicos y de factores quimiotácticos para células inflamatorias (7,12), que serían las responsables últimas de la estimulación de las células endoteliales para romper la membrana basal e iniciar un proceso más o menos controlado de formación de neovasos. Esta teoría parece que se confirma con nuestro trabajo, puesto que en los casos de animales sometidos a tratamiento con cadmio, sin inducción de hiperplasia de células de Leydig, no aparece aumento de la angiogénesis, ya que al endotelio le faltaría el estímulo de una célula tumoral que no existe. Es decir, el cadmio por sí solo no estimula la neovascularización, es condición imprescindible que aparezca primero una célula tumoral.
|
|
|
|
|
|
|
Bibliografia
|
|
|
|
1.Piédrola G, del Rey J, Domínguez M, Cortina P, Gálvez R et al. Medicina Preventiva y Salud Pública. Masson-Salvat. 1994; pp.300-301.
2.Oldereid NB, Thomasen Y, Attramadal A, Olaisen B, Purvis K. Concentrations of lead, cadmium and zinc in the tissues of reproductive organs of men. J. Reprod. Fertil. 1993; 99:421-425.
3.Parizek J, Zahor Z. Effect of cadmium salts on testicular tissue. Nature 1956; 177: 1036-1037.
4.Waalkes MP, Coogan TP, Barter RA. Toxicological principles of metal carcinogenesis with special emphasis on cadmium. Critical Reviews in Toxicology 1992; 22:175-202.
5.Rehm S, Waalkes MP. Mixed Sertoli-Leydig cell tumor and rete testis adenocarcinoma in rats treated with CdCl2. Vet Pathol 1988; 25: 163-166.
6.Clegg ED, Cook JC, Chapin RE, Foster PM, Daston GP. Leydig cell hyperplasia and adenoma formation: mechanisms and relevance to humans. Reprod Toxicol 1997; 11:107-121.
7.Collin O, Bergh A. Leydig cells secrete factors which increase vascular permeability and endothelial cell proliferation. Int J Androl 1996; 19:221-228.
8.Mendis-Handagama SMLC. Estimation error of Leydig cell number in atrophied rat testes due to the assumption of spherical nuclei. J Microscopy. 1992; 168:25-32.
9.Ariyaratne HBS, Mendis-Handagama SMLC. Changes in the testis interstitium of Sprague-Dawley rats from birth to sexual maturity. Biology of Reproduction. 2000; 62: 680-690.
10.Mayhew TM, Gundersen HJC. “If you assume, you can make an ass out of u and me”: a decade of disector for stereological counting of particles in 3D space. J Anat 1996; 188: 1-15.
11. Iglesias-Docampo A, Martín R, Martín JJ, Santamaría L. Inducción de adenomas de células de Leydig en el testículo de ratas expuestas a cloruro de cadmio. Urología Integrada y de Investigación 2002; 7:351-370.
12. Folkman J, Klagsbrum M. Angiogenic factors. Science. 1987; 235: 442-447.
|
|
|
|




